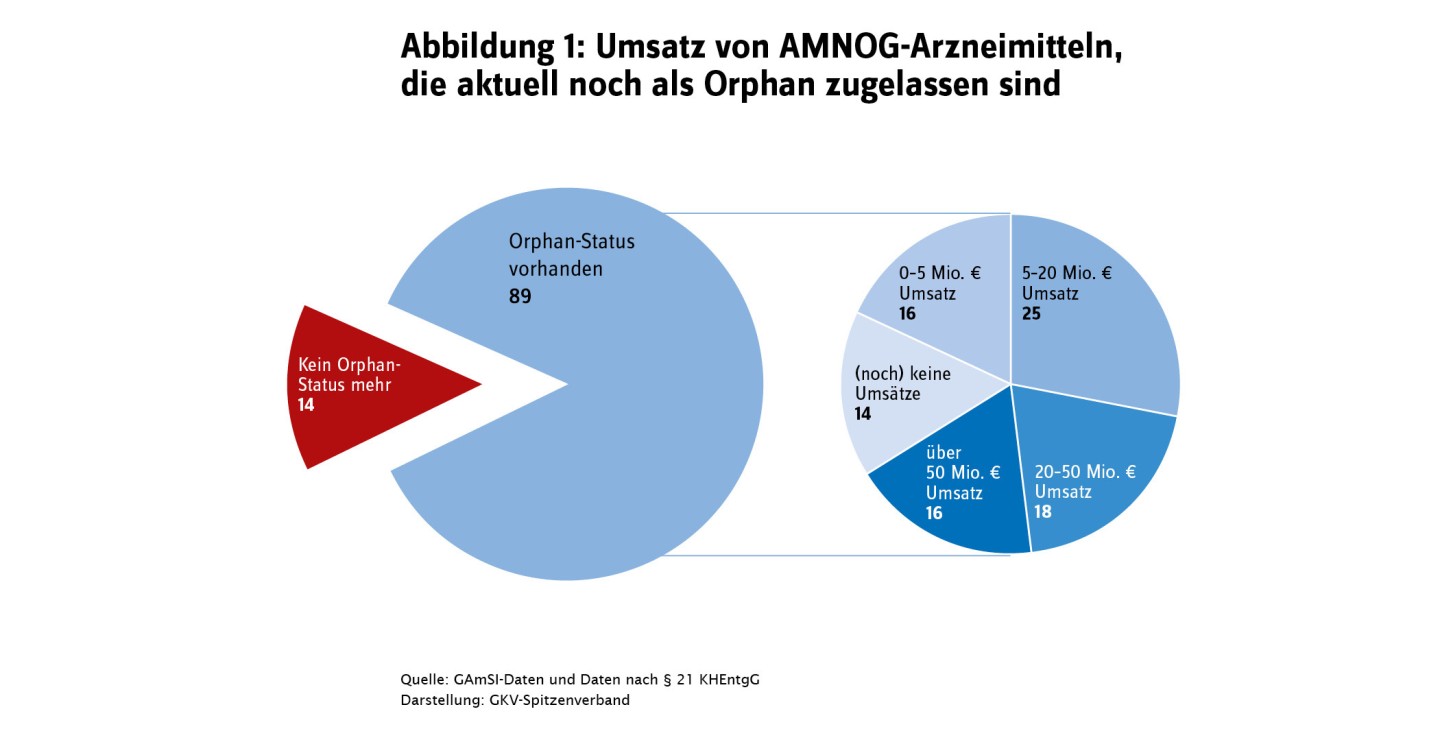
Orphan Drugs profitieren bereits vor der Zulassung durch Vergünstigungen bei der wissenschaftlich/regulatorischen Beratung durch die Zulassungsbehörde. Zudem erhalten Unternehmen für Orphan Drugs ein zusätzliches Vermarktungsschutzrecht, was den Eintritt günstiger Nachahmerpräparate zeitlich verzögern kann. Der Gesetzgeber hat festgelegt, dass Orphan Drugs ihren Zusatznutzen nicht im Rahmen einer regulären Nutzenbewertung belegen müssen, sondern dieser bereits durch die Zulassung als belegt gilt. Erst ab einer Umsatzschwelle von 50 Millionen Euro im Jahr muss der Zusatznutzen nachgewiesen werden. Diese Regelung hat zur Folge, dass der tatsächliche therapeutische Mehrwert eines Orphan Drugs lange Zeit weder den behandelnden Ärztinnen und Ärzten noch den Patientinnen und Patienten bekannt ist.
Viele Orphan Drugs ohne Zusatznutzen
Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) hat kürzlich untersucht, ob die Zusatznutzenfiktion bei Orphan Drugs gerechtfertigt ist. Ergebnis: Weniger als die Hälfte der vom IQWIG untersuchten Orphan-Drug-Bewertungen hatte tatsächlich einen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie. Das heißt, dass die Hoffnung der Patientinnen und Patienten und der verschreibenden Ärztinnen und Ärzte auf einen echten Fortschritt bei der Behandlung der jeweiligen Krankheit durch ein bestimmtes Produkt sich oft nicht erfüllt. Um mehr Transparenz und Klarheit für Erkrankte zu schaffen, wäre es notwendig, dass Hersteller zum einen aussagekräftige Studien vorlegen und zum anderen dass die Sonderregelungen für Orphan Drugs entfallen.