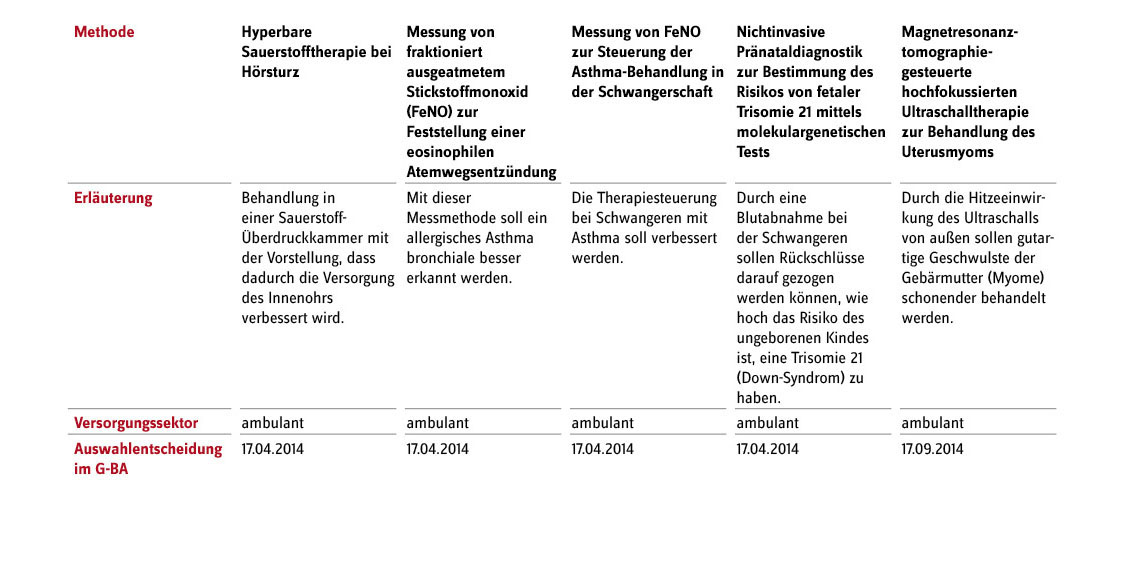
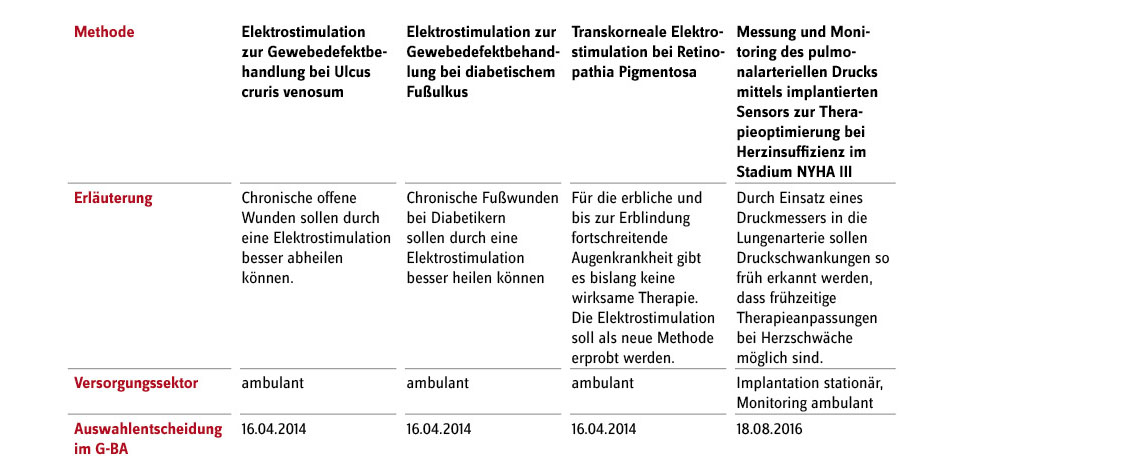
Literatur
Berkhemer, O., Fransen, P., Beumer, D. et al. (2015). A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med. 372(1):11-20.
BfArM (2015). Folgeinformation zum Produkt Nanostim™ Nanostim™ elektrodenloser Herzschrittmacher und Einführsystem-Katheter, St. Jude Medical vom 10.03.2015. http://www.bfarm.de/SharedDocs/Kundeninfos/DE/01/2015/04254_14_Kundeninfo_de.pdf?__blob=publicationFile&v=5 [Abruf am 30.11.2016].
BfArM (2016). Dringende Sicherheitsmitteilung für Nanostim Leadless Cardiac Pacemaker (LCP) / Modellnummer S1DLCP, St. Jude Medical vom 3.11.2016. http://www.bfarm.de/SharedDocs/Kundeninfos/DE/01/2016/08980_16_Kundeninfo_de.pdf?__blob=publicationFile&v=2 [Abruf am 30.11.2016].
Bose, A., Hartmann, M., Henkes, H. et al. (2007). A novel, self-expanding, nitinol stent in medically refractory intracranial atherosclerotic stenoses: the Wingspan study. Stroke 38(5):1531-1537.
Chimowitz, M., Lynn, M., Derdeyn, C. et al. (2011). Stenting versus Aggressive Medical Therapy
for Intracranial Arterial Stenosis. New England Journal Med 365(11):993–1003.
Deyo, R., Patrick, L. (2005). Hope or Hype. The obsession with medical advances and the high cost of false promises. New York: Amacom Verlag.
Fransen, P., Beumer, D., Berkhemer, O. et al. (2014): MR CLEAN, a multicenter randomized clinical trial of endovascular treatment for acute ischemic stroke in the Netherlands: study protocol for a randomized controlled trial. Trials 15:343.
Hacke, W., Ringleb, B., Jansen, O. und Eckstein H. (2014). Asymptomatische Karotisstenosen: Eine verpasste Chance. Dtsch Ärztebl 112(7): A-272 / B-234 / C-230.
Hermann Frank, A. und Lelgemann, M. (2013). Neue Medizinprodukte: Unzureichende Datenlage. Dtsch Ärztebl 110(10): A-432 / B-390 / C-390.
IQWiG (2015). Allgemeine Methoden Version 4.2 vom 22.04.2015. S. 6 ff. https://www.iqwig.de/download/IQWiG_Methoden_Version_4-2.pdf [Abruf am 07. Nov.2016]
Koalitionsvertrag (2013). Deutschlands Zukunft gestalten. Koalitionsvertrag zwischen CDU, CSU und SPD. 18. Legislaturperiode. 13.12. 2013 S. 57. https://www.bundesregierung.de/Content/DE/_Anlagen/2013/2013-12-17-koalitionsvertrag.pdf?__blob=publicationFile [Abruf am 21.11.2016]
Lelgemann, M. (2009). Innovationen und ihre Bewertung: Eine Frage der Perspektive. G+G Wissenschaft 9(1): 15-21.
Reddy, V., Knops, R., Sperzel, J. et al. (2014). Permanent leadless cardiac pacing: results of the LEADLESS trial. Circulation 129(14):1466-1471.
Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen 2014 [online] S. 186, abrufbar unter: http://www.svr-gesundheit.de/fileadmin/user_upload/Gutachten/2014/SVR-Gutachten_2014_Langfassung.pdf [Abruf am 07. Nov. 2016]
Windeler, J., Antes, G., Behrens, J., et al. (2008). Randomisierte kontrollierte Studien: Kritische Evaluation ist ein Wesensmerkmal ärztlichen Handelns. Dtsch Arztebl;105(11), A-565 / B-502 / C-491.
Zaidat, O., Fitzsimmons, B., Woodward, B. et al. (2015). Effect of a balloon-expandable intracranial stent vs medical therapy on risk of stroke in patients with symptomatic intracranial stenosis: the VISSIT randomized clinical trial. JAMA 313(12):1240-1248.