AMNOG
Gesetz bremst medizinischen Fortschritt nicht aus
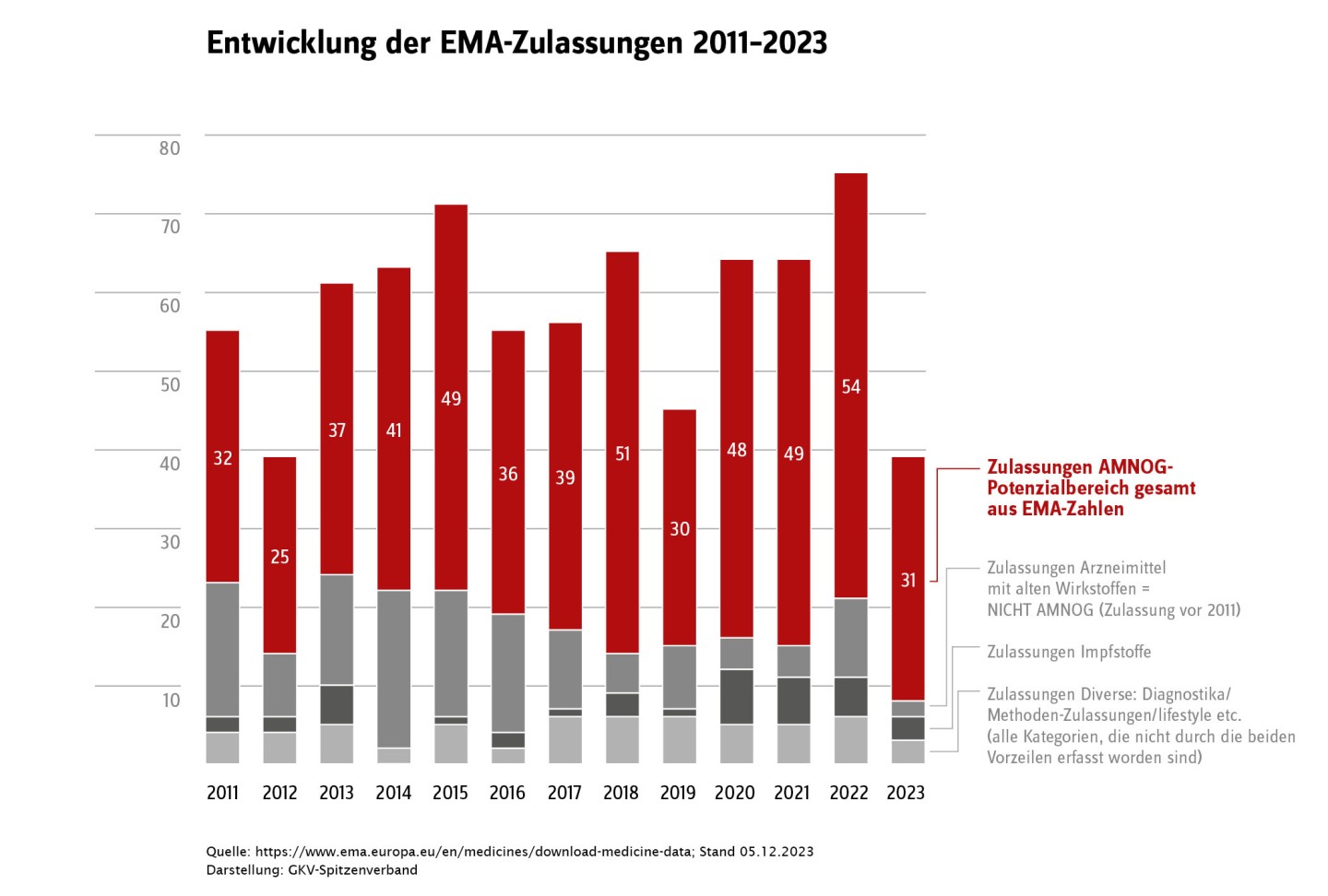
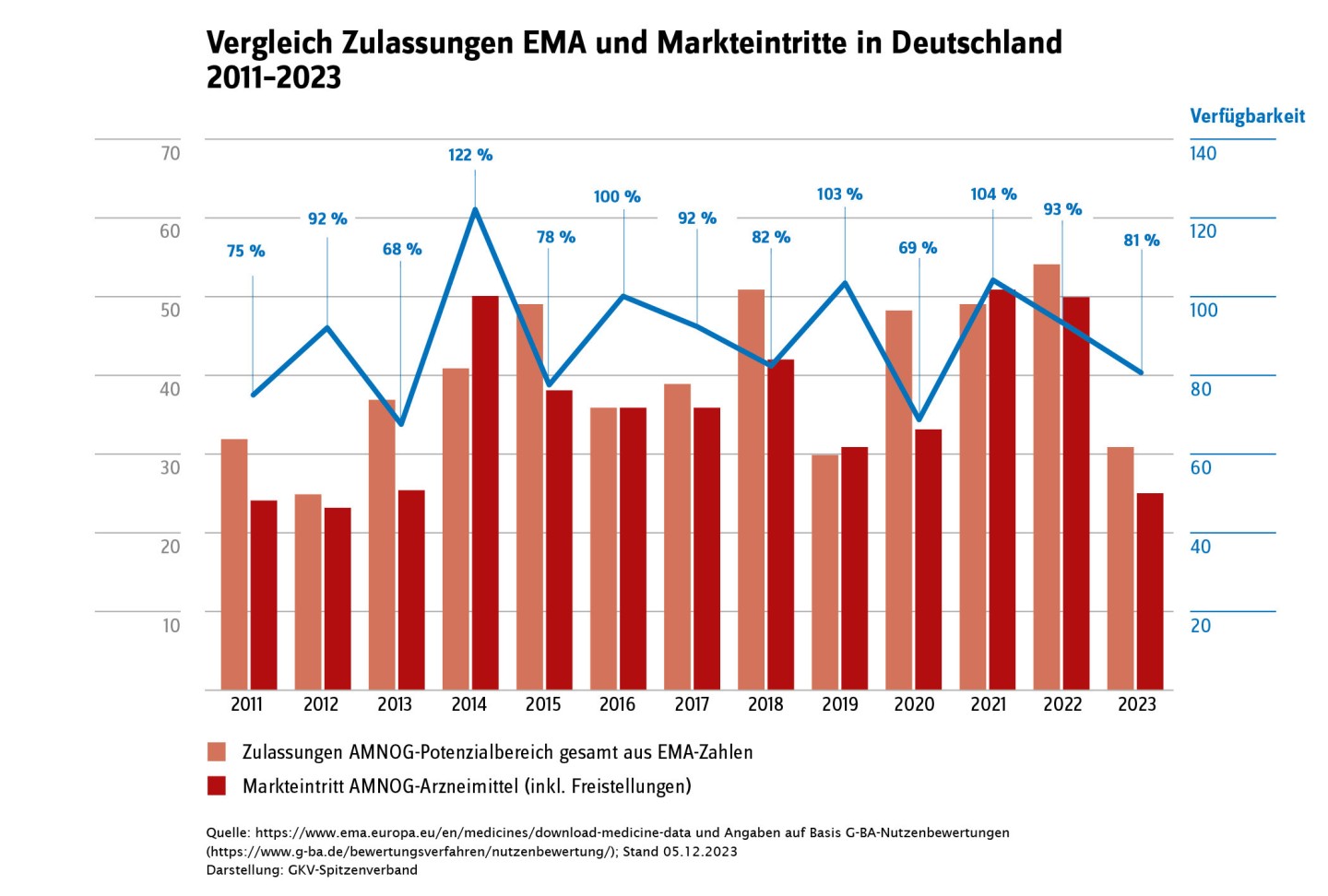
Gefährdet das GKV-Finanzstabilisierungsgesetz (FinStG) die Versorgung mit neuen Arzneimitteln? Das zumindest behauptet die Pharmaindustrie (vgl. z. B. Pressemitteilungen des Verbands Forschender Arzneimittelhersteller (vfa) vom 19. Dezember 2023 und vom 10. Januar 2024): Im Jahr 2023 seien wegen des 2022 in Kraft getretenen GKV-Finanzstabilisierungsgesetzes (GKV-FinStG) weniger Arzneimittel in den deutschen Markt eingetreten.