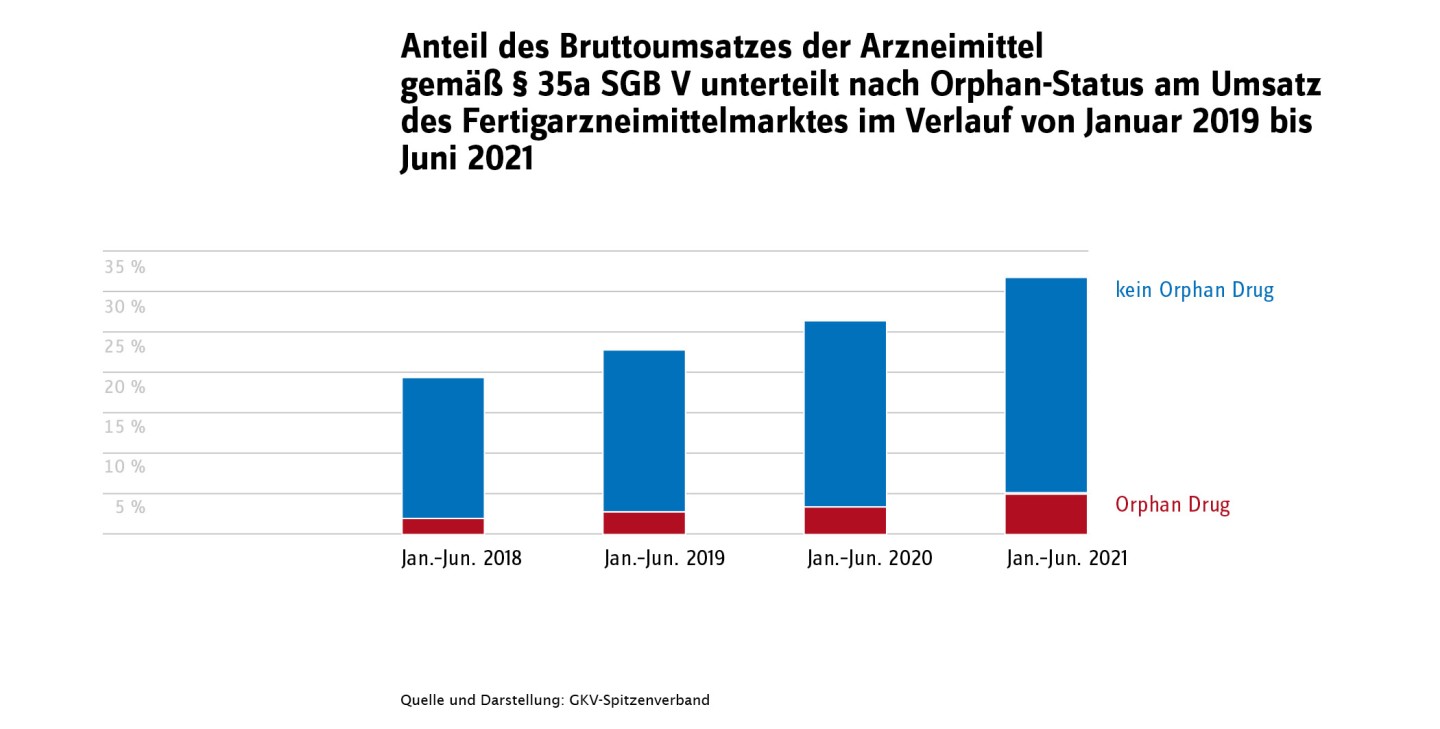
Mit dem Arzneimittelmarktneuordnungsgesetz (AMNOG) wurde festgelegt, dass ab 1. Januar 2011 der Gemeinsame Bundesausschuss (G-BA) für neue Wirkstoffe eine Nutzenbewertung gemäß § 35a SGB V durchführt. Die Nutzenbewertung führt entweder zur Zuordnung in eine Festbetragsgruppe oder dient als Grundlage für die Preisverhandlung zwischen pharmazeutischem Unternehmen und dem GKV-Spitzenverband. Seit Inkrafttreten des Gesetzes wurde für mehr als 300 Wirkstoffe eine Nutzenbewertung durchgeführt. Der Anteil des Umsatzes überschreitet im ersten Halbjahr 2021 mit 6,74 Milliarden Euro erstmals 30 Prozent des Gesamtumsatzes im Fertigarzneimittelmarkt (s. Abbildung 1).
Der steigende Trend ist durch immer mehr Arzneimittel, die mit neuen Wirkstoffen und einem relativ hohen Preisniveau auf den Markt kommen, bedingt. So liegt der Bruttoumsatz je definierter Tagesdosis (DDD) für Arzneimittel gemäß §35 a SGB V im ersten Halbjahr 2021 bei ca. 7,48 Euro und für den nicht-generikafähigen Markt bei 5,39 Euro, während er für den Gesamtfertigarzneimittelmarkt bei 1,02 Euro liegt.
Unter den 20 umsatzstärksten Fertigarzneimitteln befinden sich insgesamt zwölf, die ein Nutzenbewertungsverfahren nach §35a SGB V durchlaufen haben (s. Tabelle 7 des aktuellen GAmSi-Berichts). Das umsatzstärkste Fertigarzneimittel Eliquis® mit dem Wirkstoff Apixaban, das u.a. zur Prophylaxe von Thrombosen und Schlaganfällen genutzt wird, fällt z.B. unter das AMNOG.